|
|
|
|
|
|

|
| |
1.硅元素(Silicon)与硅酮(Silicone)
硅元素(silicon)与硅酮(silicone),这两个术语乍一看,英语上似乎很相似,但在化学上却是有着严格区分的概念。
Silicon是指以化学符号Si表示的暗灰色金属硅,是一种暗灰色金属性物质。而今天大部分产业领域必须使用的高功能材料-硅酮(silicone),是一种兼备有机性与无机性的独特的化学材料,是指有机硅化合物(organosilicone)和硅氧烷(Siloxane)相互连接成的聚合体。
追溯这一名称的由来,硅元素学者A.LADENBURG认为,(C2H5)2SiCl2的加水分解脱水生成物具有与酮((C2H5)2C=O
)类似的结构-(C2H5)2Si=O,于是将其称为Silico-Ketone,以后的1905年,W.DILTHEY证实脱水生成物是环状(Cyclic)的,Silico-Ketone名称经过简化,变成了『Silicone』,成为硅酮化合物的统称,这一术语就此制定并被广泛使用。
|
| |
| 2.硅元素和碳元素 |
|
|
|
|
硅酮的分子骨架由硅元素(Si)和氧元素(O)构成,在这一点上,与以碳元素(C)为主骨架的一般合成高分子有着本质的不同。
碳元素(C)和硅元素(Si)在元素周期表上同属于第四族,碳元素(C)为第2周期,硅元素(Si)为第3周期,两者相邻,因此可以推定两者性质相似。从上图可知,碳元素或硅元素才有4个共价键,构成以原子为中心的正四面体形。
但3周期元素比2周期元素多一个电子轨道,从这点而言,两种元素在化学性方面有着差异。
首先,与碳元素的共价键半径0.77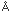 相比,硅元素的共价键半径是1.17 相比,硅元素的共价键半径是1.17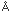 ,约是碳的1.5倍。共价键半径对元素的性质产生绝对的影响。 ,约是碳的1.5倍。共价键半径对元素的性质产生绝对的影响。
另外,如下表所示,由于负电性的差异,其物理化学性质,即键能等方面也存在差异。在负电性方面,硅元素比碳元素小,而近似于同族的金属Ge或Sn,容易从分子中获得电子。此外,硅元素生成双键及三键的倾向很小,配价键性大,这也是与碳元素原子不同之外。 |
|
| 负电性 |
|
H2.1 |
|
|
|
|
|
|
|
Li
1.0 |
Be
1.5 |
B
2.0 |
C
2.5 |
N
3.0 |
O
3.5 |
F
4.0 |
|
Na
0.9 |
Mg
1.2 |
Al
1.5 |
Si
1.8 |
P
2.1 |
S
2.5 |
Cl
3.0 |
|
K
0.8 |
Ca
1.0 |
Sc
1.3 |
Ge
1.7 |
As
2.0 |
Se
2.4 |
Br
2.8 |
|
Rb
0.8 |
Sr
1.0 |
Y
1.3 |
Sn
1.7 |
Sb
1.8 |
Te
2.1 |
I 2.4 |
|
Cs
0.7 |
Ba
0.9 |
|
|
|
|
|
|
| |
| 3.硅酮的物理、化学性质 |
|
硅酮的最大特征之一在于强耐热及抗氧化,这可以通过化学键强度来说明。如右表所示,作为硅酮主骨架的Si-O键比其它键都要大,这是因为Si和O的负电性差异较大所致,Si-O键近似于离子键,从能量上讲更稳定,这正是原因之一。
|
|
|
|
键能
( Kcal
/ mol
) |
|
C
|
Si |
|
C |
83.2 |
58
~ 80 |
|
Si |
58
~ 80 |
45.0 |
|
H |
98.8 |
72.6 |
|
O |
83.2 |
101.0 |
|
|
| 硅酮的耐热、耐氧化性良好,即,可以在高温下使用,这是实用上的重要特征之一。 |
| 液体的表面张力 (温度 : 20℃)
|
|
与象C-C这种单纯的共价键不同,由于Si-O键处于离子键和共价键的中间状态,分子间引力小,因此,与其它液体相比,硅酮油的表面张力特别低。也正是由于这种原因,硅橡胶及硅酮油具有非常优秀的耐寒性,对各种物性值的温度依存度低,这是在实用上又一重要特征。 |
|
液体的种类 |
表面张力(dyn/cm) |
|
|
二甲硅油 |
20
~ 21 |
|
氯化物油 |
18
~ 19 |
|
Tetra
decane |
26.5 |
|
液体状石蜡 |
29.7 |
|
聚乙烯 |
34
~ 36 |
|
甲苯 |
28.5 |
|
甘油 |
63.1 |
|
水 |
72 |
|
|
|